Определение
Микробная контаминация — непреднамеренное или случайное попадание инфекционных агентов, таких как бактерии, грибки, простейшие, или их токсинов и субпродуктов в инфузионную систему 1, 2.
«Нозокомиальная инфекция, также именуемая внутрибольничной, определяется как любое клинически распознаваемое инфекционное заболевание, которое развилось у пациента в результате его обращения в ЛПУ за лечебной помощью или пребывания в нем, а также любое инфекционное заболевание сотрудника ЛПУ, развившееся вследствие его работы в данном учреждении, вне зависимости от времени проявления симптомов (после или во время нахождения в ЛПУ)»³.
Типы патогенных микроорганизмов
Существует множество патогенных микроорганизмов, которые могут стать причиной контаминации и вызвать заболевание.
Бактерии
Микроорганизмы размером более 5 мкм, представляющие наиболее важную группу патогенов, создающих угрозу при микробной контаминации. В зависимости от строения клеточной мембраны бактерии подразделяются на грамположительные и грамотрицательные. Бактерии также можно разделить на условно-патогенную и патогенную микрофлору.
Условно-патогенная микрофлора
Относится к нормальной флоре здорового человека. Обычно не наносит вреда здоровью и даже играет защитную роль, препятствуя колонизации патогенными микроорганизмами. Однако некоторые типы условно-патогенной флоры могут стать причиной инфекционного заболевания в случае ослабления иммунитета или проникновения в кровоток 3.
Патогенная микрофлора
Высоко вирулентна и является причиной возникновения инфекции вне зависимости от состояния иммунитета 3.
Вирусы
Субклеточный инфекционный агент размером 20–200 нм, который может воспроизводиться только внутри живых клеток организма. По своей природе вирусы являются автономными генетическими элементами с внеклеточной стадией в цикле развития, которые могут стать причиной опасных для жизни заболеваний 3.
Прионы
Прионы — белковые инфекционные частицы. Патогены размером менее 5 нм. Вирусы и прионы — инфекционные агенты, у которых отсутствует обмен веществ. Вне клетки вирусные частицы не проявляют признаков живого организма и ведут себя как частицы органических полимеров. Размножение происходит внутри клетки-хозяина 3.
Грибки, дрожжи и простейшие
Грибки, дрожжи и простейшие размером более 200 мкм могутстать источником инфицирования 3.
Определение катетер-ассоциированной инфекции кровотока (КАИК)
Определение КАИК помогает понять, действительно ли катетер стал первопричиной развившейся у пациента бактериемии. Оно включает понятие инфекции места введения катетера и туннельной инфекции, которые имеют следующие проявления:
- гиперемия, болезненность, уплотнение или нагноение кожи в пределах 2 см от места введения катетера при отрицательных результатах культурального исследования крови;
- для туннельной инфекции характерны гиперемия, болезненность, уплотнение или нагноение кожи в пределах 2 см от места введения катетера при отрицательных результатах культурального исследования крови 5.
Микробиологическое загрязнение представляет особую угрозу для пациентов, которым проводится инфузионная терапия и установлен внутривенный катетер. В этом случае патогенные микроорганизмы напрямую попадают в сосудистое русло и могут стать причиной катетер-ассоциированной инфекции кровотока (КАИК) или доставляться к органам и системам, приводя к органной недостаточности.
По этой причине профилактика КАИК крайне важна. В середине 1990-х годов Центр надзора и профилактики заболеваемости (CDC) опубликовал стандартное определение КАИК, которое максимально подробно раскрывает его понятие 6.
Антибиотикотерапия — наиболее эффективный метод лечения бактериальных инфекций. Однако иногда ее эффективное проведение крайне осложнено или даже невозможно по причине полирезистентности микроорганизмов к действию антибиотиков. Против большинства вирусов и всех прионов действенных лекарственных средств не существует. Поэтому профилактика этих инфекции является крайне важной задачей.
Распространенность случаев MRSA
Инфекции, вызванные метициллин-устойчивым золотистым стафилококком (MRSA) вызывают серьезную озабоченность со стороны специалистов во всем мире. MRSA — один из штаммов золотистого стафилококка, обладающего выраженной устойчивостью к действию бета-лактамных антибиотиков, таких как пенициллины (метициллин, диклоксациллин, нафциллин, оксациллин и пр.) и цефалоспорины.
Согласно данным Центра надзора и профилактики заболеваемости (CDC), MRSA составляют 1 % случаев стафилококковых инфекций и более чем 50 % случаев внутрибольничных стафилококковых инфекций. После эпидермального стафилококка золотистый стафилококк занимает второе место среди наиболее распространенных причин внутрибольничных инфекций в Соединенных штатах Америки, и 49 % случаев с высокой степенью резистентности MRSA к проводимой антибиотикотерапии 9.
Штамм, именуемый USA100 — наиболее распространенный тип MRSA, встречающийся в качестве возбудителя внутрибольничной инфекции в клиниках США 8. Наиболее часто заражение MRSA возникает в клиниках или при лечении на дому у пациентов, находящихся на ИВЛ, имеющих инвазивные устройства, с ослабленным иммунитетом, так как в этом случае высок риск генерализации инфекции. Каждый год в США регистрируется более 290 000 случаев инфицирования золотистым стафилококком у госпитализированных пациентов. При этом из всего количества стафилококковых инфекций приблизительно 126 000 случаев вызваны MRSA 9.
Нозокомиальная инфекция является основной причиной заболеваемости и летальности. В будущем нозокомиальная инфекция станет не только проблемой здравоохранения, но и будет оказывать влияние на экономическую и социальную сферы в связи со следующими факторами:
- рост численности и плотности населения;
- учащение случаев иммунодефицита (возраст, заболевания и лечение);
- появление новых микроорганизмов;
- возрастание числа случаев полирезистентности микроорганизмов к антибиотикам 4.
Определение полирезистентности микроорганизмов
Полирезистентность — свойство патогенного микроорганизма, позволяющее ему быть устойчивым к действию широкого спектра лекарственных средств и препятствующее его эрадикации 10.
Примеры полирезистентности микроорганизмов
- Метициллин-устойчивый золотистый стафилококк (MRSA)
- Ванкомицин-устойчивый энтерококк (VRE)
- Грамотрицательные бактерии продуценты бета-лактамаз расширенного спектра действия (ESBLs)
- Klebsiella pneumoniae продуцент карбапенемазы (KPC)
- Имипенем-устойчивый Acinetobacter baumannii
- Имипенем-устойчивый Pseudomonas aerginosa
- Полирезистентная микобактерия туберкулеза (MDR-TB) и тотально полирезистентная микобактерия туберкулеза (XDR-TB).
Знаете ли вы, что...

2 WHO; Presentation: WHO_Facts_DRT661; „Health-Care Associated Infection and Hand Hygiene Improvement - Slides for the Hand Hygiene Co-ordinator of the WHO“ http://www.who.int/gpsc/country_work/gpsc_ccisc_fact_sheet_en.pdf
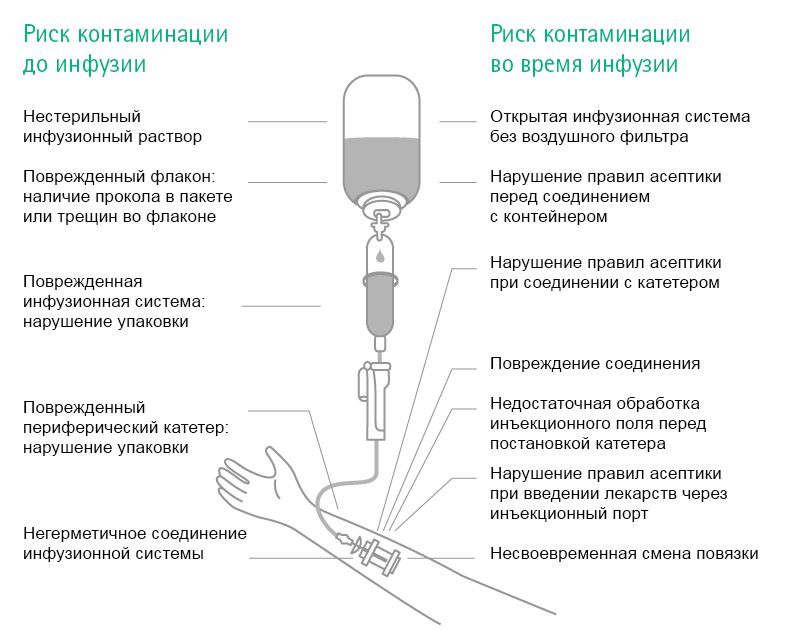
Причины
Контаминация означает непреднамеренное попадание болезнетворных бактерий в организм пациента и нанесение ему вреда.
Возможные источники и пути передачи
Контаминация означает непреднамеренное попадание болезнетворных бактерий в организм пациента и нанесение ему вреда. Существует несколько возможных источников и путей передачи.
- Источники: естественные отверстия организма или искусственно созданные в результате повреждения или болезни
- Входные ворота инфекции: естественные отверстия организма или искусственно созданные в результате повреждения или болезни
- Прямая передача контактным или воздушно-капельным путем
- Непрямая передача через поверхности и инструменты
- Непрямая передача инфекции через переносчиков: комаров, мух, грызунов
- Непрямая передача инфекции через промежуточного хозяина (человек, животное или насекомое, например, передача малярии через укусы комаров)
Основным источником контаминации в учреждениях здравоохранения являются руки медицинского персонала.
Инфекции, полученные во время инфузии
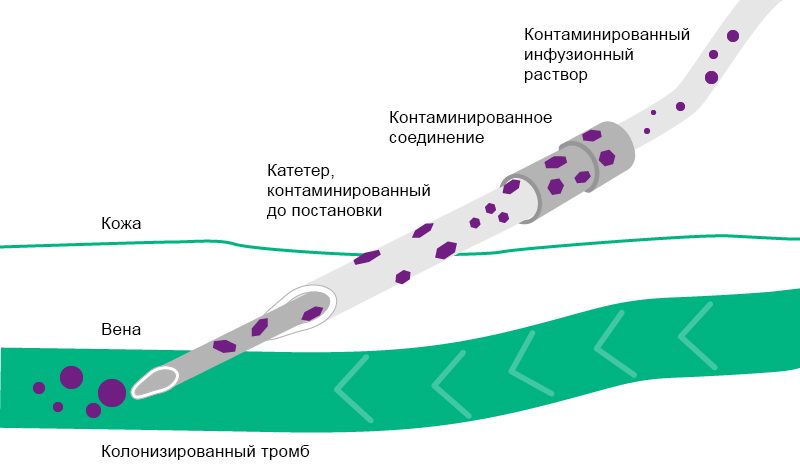
Контаминация происходит в случаях, если какая-либо часть системы, устройства или препарата контактирует с патогенным микроорганизмом в той части, которая должна оставаться стерильной. Например, в результате контаминации хирургического инструментария происходит инфицирование операционной раны. Типичные возбудители такого типа инфекции представлены ниже. Во время манипуляций происходит контаминация инфузионной системы в результате попадания патогенов внутрь инфузионной линии.
Относительно инфекций, обусловленных инфузией, существует два отдельных пути контаминации: внепросветный и внутрипросветный. Внутрипросветная контаминация — последствие нарушения правил использования инфузионной системы, например, муфты катетера во время соединения и отсоединения инфузионной системы. Это наиболее распространенный источник инфекции после первой недели постановки катетера 11–13.
Последствия
Проблема внутрибольничных инфекций затрагивает как развитые, так и бедные страны. Инфекции, заражение которыми происходит в учреждениях здравоохранения, являются лидирующей причинной смертности среди госпитализированных пациентов. Также с ними связано существенное бремя расходов, которое несет как пациент, так и система здравоохранения. Официальное исследование распространенности нозокомиальной инфекции было проведено Всемирной организацией здравоохранения (ВОЗ) в 55 клиниках в 14 странах, где есть представительства ВОЗ (Европа, Восточное Средиземноморье, Юго-Восточная Азия, Западный Тихоокеанский регион). Оно показало, что у 8,7 % госпитализированных пациентов возникают осложнения, связанные с внутрибольничной инфекцией. В то же время свыше 1,4 миллиона человек во всем мире страдают от инфекционных осложнений, полученных в результате нахождения в стационаре 15.
Наибольшее количество случаев внутрибольничной инфекции было зарегистрировано в клиниках Восточного Средиземноморья и Юго-Восточного региона (11,8 и 10 % случаев), распространенность в Европе и Западном Тихоокеанском регионе — соответственно 7,7 и 9 % 16.
Чаще всего происходит инфицирование хирургических ран, урогенитального тракта и дыхательных путей.
Исследование ВОЗ, а также другие исследования продемонстрировали высокую распространенность случаев нозокомиальной инфекции в отделениях реанимации, экстренной хирургии и травматологии. Уровень заражения выше среди ослабленных лиц преклонного возраста, пациентов с сопутствующими заболеваниями, пациентов, которым проводится химиотерапия 3.
Контаминация и последующее инфицирование может быть локальным или системным.
- Локальное инфицирование может проявляться воспалением хирургической раны, покраснением кожного покрова или места входа катетера.
- В случае системной воспалительной реакции, возникающей в результате попадания патогенных микроорганизмов в кровоток, могут развиться такие опасные для жизни патологические процессы как септицемия, септический шок, эндокардит, остеомиелит с возможной последующей ампутацией конечности.17,18
В случае развития инфекционных осложнений требуются дополнительные диагностические и лечебные процедуры, которые могут стать причиной дискомфорта, эмоционального напряжения для пациента, усилить побочные эффекты, причинить боль. В результате значительно ухудшается качество жизни.
Наряду с этим увеличивается время пребывания пациента в стационаре 19. Одно из проведенных исследований продемонстрировало следующее увеличение количества койко-дней: при раневой инфекции — на 8,2 дня, гинекологической инфекции — до 3 дней, для общей хирургии — до 9,9 дней и 19,8 дней — для травматологи.
Исследование EPIC II, изучающее частоту заболеваемости за определенный период времени у пациентов, находящихся в критическом состоянии, было проведено 8 мая 2007 года с целью оценить показатель смертности от инфекционных осложнений, связанных с присоединением метициллин-устойчивого золотистого стафилококка. В день исследования 7 087 (51 %) из 13 796 участвовавших пациентов были классифицированы как инфицированные. Из них 494 пациента инфицированы MRSA и 505 MSSA (метициллин-восприимчивый золотистый стафилококк). Смертность составила 29,1 и 20,2 % соответственно (P < 0,01). Множественный анализ госпитальной смертности от MRSA инфекции продемонстрировал рассчитанный относительный риск смертности 1,46 (P = 0,03).
У пациентов, находящихся на лечении в ОРИТ, MRSA является независимым фактором увеличения вероятности госпитальной смертности на 50 % в сравнении с MSSA инфекцией 19. Другие исследования показали, что уровень смертности от инфекции кровотока находится в пределах 10–25 %, а в случае развития у пациента септического шока этот показатель возрастает до 40–60 % 21. Таким образом, нозокомиальная инфекция является одной из главных причин смертности 22.
Финансовые затраты
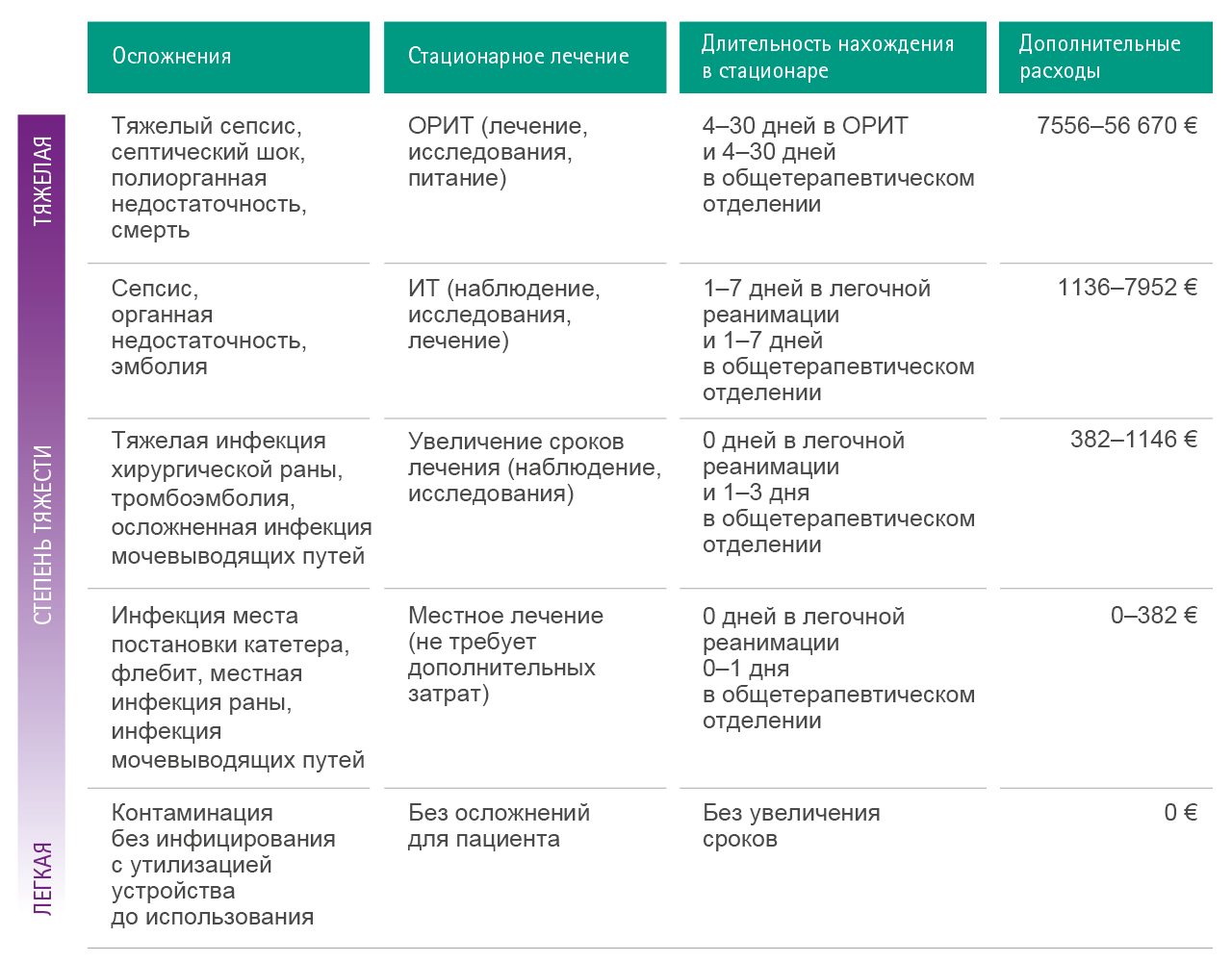
Предотвращение контаминации медицинских изделий и инфузионных растворов, и, следовательно, предовтращение развития тяжелой инфекции и сепсиса имеет первостепенное значение в условиях стационара и может привести к ощутимой экономии средств для всего лечебного учреждения. В некоторых случаях такие осложнения, как сепсис, необходимо лечить в условиях полноценного отделения интенсивной терапии, что может выразиться в затратах до 56 670 € на одного пациента.
Экономические последствия нозокомиальной инфекции
В исследовании Uslusoy et al. 17 изучено более чем 2 миллиона причин внутрибольничных инфекций, имеющих место ежегодно (5,7 случаев на 100 госпитализаций), со средним увеличением стоимости койко-дня до 1393 $. В случае с метициллин-устойчивым золотистым стафилококком расходы возрастают до 3536 €.
Осложнения, связанные с внутрибольничной инфекцией, ежегодно происходят более чем в двух миллионах случаев госпитализаций 38. Экономические потери из-за проблемы внутрибольничных инфекций значительны 37, 39. Значительную часть расходов составляет увеличение сроков пребывания в стационаре инфицированных пациентов 6, 19, 40. В результате дополнительные расходы из-за смертности и роста общей стоимости лечения пациента составляют приблизительно 40 000 $ 40,41.
В исследовании, проведенном Rello, при оценке последствий инфицирования места установки катетера у пациентов в критическом состоянии было установлено, что сроки пребывания в стационаре выживших пациентов увеличились на 19,6 дней 42. Речь идет только о добавленной стоимости одного койко-дня в размере 3214 €, без учета всей длительности пребывания и расходов на диагностические и лечебные процедуры.
Vandijck исследовал ежедневные расходы на антибактериальную терапию инфекции кровотока у пациентов, находящихся на лечении в ОРИТ 43. Ежедневные расходы составили 114,25 € на одного пациента. Средняя продолжительность антибактериальной терапии инфицированных пациентов была в пределах от 7 до 14 дней, общие расходы на проведенние антибактериальной терапии у одного пациента находилась в диапазоне от 800 до 1200 €. В случае резистентности возбудителя к действию широкоприменяемых антибиотиков расходы возрастали до 8480 $ на одного пациента (приблизительно 5000 €) 44.
На основе систематического научного обзора за период 1990–2000 гг. были определены следующие средние расчеты, относящие к затратам (стоимость, вычисленная при анализе контрольной группы пациентов и включающая только прямые расходы клиники) на лечение осложнений.
- Внутрибольничная инфекция, средние расходы — 13 973 $
- Инфекция кровотока, расходы — 36 441 $
- Метициллин-устойчивый золотистый стафилококк, расходы — 35 367 $
- Инфекция хирургической раны, расходы — 25 546 $
- Пневмония, расходы — 9969 $
По следующим типам инфекций специальных исследований не проводилось, но затраты на лечение общеизвестны.
- Инфекция мочевыделительной системы, расходы — 1008 $
- Вирус опоясывающего лишая, расходы — 27 377 $
- Туберкулез, расходы — 61 446 $
- Корь, расходы — 41 087 $
После проведенного анализа данных источников Roberts и соавт. создали экономическую модель, основанную на примере пациентов клиники Университета Раша, в которой были подсчитаны расходы на лечение пациентов со средней степенью тяжести состояния, находящихся в ОРИТ, и определены средние расходы на одного пациента в размере 15 275 $ 41, 45.
В другом недавно проведенном исследовании были проанализированы национальные данные и результаты, полученные методом распределения «случай-контроль» с учетом диагностически связанных групп, пола, расы, возраста и сопутствующих заболеваний, и получены средние расходы на инфекцию, связанные с оказанием медицинской помощи, в размере 38 656 $ 42.
Расходы на устранение осложнений, связанных с внутрибольничной инфекцией, могут легко возрасти до миллионов долларов 46.
Необходимо учитывать не только прямые затраты, связанные с увеличение продолжительности нахождения в клинике, но и косвенные расходы, возникающие в связи с нетрудоспособностью. Необходимость изоляции пациента и проведения дополнительный лечебных и диагностических процедур также увеличивает общие затраты.
Внутрибольничные инфекции приводят к дисбалансу между распределением ресурсов для первичной и вторичной медицинской помощи, перераспределяя ресурсы из фонда экстренной помощи на потенциально предотвратимые нужды
1 октября 2008 Центр координации программ «Медицинский уход» и «Медицинская помощь» (CMS) принял решение о прекращении оплаты клиникам части расходов, направленных на устранение осложнений, причиной которых стали медицинские ошибки и недостаточный уход, которые можно было предотвратить 47.
Даже нефатальные последствия присоединения нозокомиальной инфекции приводят к дополнительным диагностическим процедурам (например, посевы, лабораторные исследования, рентген) и лечебным мероприятиям (например, применение антибиотиков, катехоламинов), увеличению длительности пребывания в стационаре и среднесуточной стоимости в связи с проводимой терапией 48–50.
Расчет затрат
Пациенты с сепсисом, у которых инфекция протекает в тяжелой форме, находятся на лечении в ОРИТ, где обеспечивается круглосуточное наблюдение, высокий уровень специализированной помощи, необходимое оборудование. Расходы на содержание персонала составляют от 40 до 60 % от всего бюджета ОРИТ. Из-за высокого процента фиксированных затрат на лечение в ОРИТ общая стоимость лечения напрямую зависит от длительности пребывания пациента в данном отделении (реанимационный койко-день). Средняя общая стоимость койко-дня в ОРИТ приблизительно составляет 1200 € для стран с высокоразвитой системой (основано на анализе результатов исследований, проведенных с 1989 по 2001 гг.).
Лечение пациентов, состояние которых требует длительного нахождения в ОРИТ, обходится значительно дороже по сравнению с лечением других пациентов ОРИТ. Прямые затраты на лечение пациентов с сепсисом в США достигают 34 000 €, в то время как европейские данные находятся в пределах от 23 000 € до 29 000 €. Нужно отметить, что прямые затраты на лечебно-диагностические процедуры составляют приблизительно 20–30 % от общей стоимости. Косвенные затраты, связанные с тяжелым течением сепсиса, составляют 70–80 % от всех затрат и состоят, главным образом, из потерь, связанных с нетрудоспособностью и смертностью 51.
В таблице ниже схематично приведены примеры затрат, связанные с новокомиальной инфекцией 52.
Профилактические мероприятия
В последние годы профилактика микробной контаминации и, как следствие, внутрибольничной инфекции, имеет важное значение из-за серьезного значения этой проблемы для системы здравоохранения и экономики в целом. Медицинское сообщество, лечебные учреждения и правительства инвестируют средства в проведение исследований и разработку рекомендаций для профилактики внутрибольничной инфекции 3, 6, 9, 10, 23–25.
Образование и обучение
Высокий уровень подготовки медицинских работников с соответствующими знаниями, навыками и мотивацией для функционирования системы инфекционного контроля на рабочем месте — самый важный метод профилактики инфекции. Должны проводиться ознакомительные программы, постдипломное образование, обучение на рабочем месте и курсы повышения квалификации медицинского персонала 9, 25.
Среди всех существующих мер гигиена рук имеет самое важное значение для профилактики инфицирования, а также обязательное использование перчаток и другого безопасного оборудования (см. рис. 6, 7). Всемирная организация здравоохранения и CDC провели кампанию, условно называемую «Мойте ваши руки», во время которой размещались плакаты, проводилось обучение, открывались веб-сайты и распространялись рекомендации по гигиене рук 9, 26–28. Соблюдение гигиены рук сокращает количество случаев MRSA на 50 % 29.
Наблюдение и контроль
Внедрение системы мониторинга и наблюдения в ОРИТ за пациентами, для которых существует риск присоединения внутрибольничной инфекции и осложнений при проведении инфузионной терапии, оказалось успешным на практике для предупреждения ошибок в системе инфекционного контроля.
Например, внедрение системы инфекционного контроля в Нидерландах смогло снизить распространенность MRSA ниже 1 % от всех клинических случаев, достигнув, таким образом, одного из самых низких показателей внутрибольничной инфекции во всем мире 30–32.
Инженерные и технические решения
- Использование стерильных одноразовых устройств
- Применение закрытых систем и устройств (см. рис. 7) 35.
- Использование прозрачных перевязочных материалов для фиксации канюль и катетеров
- Коммерчески доступные стерильные внутрисосудистые устройства, произведенные в промышленных условиях. Контаминация инфузионных растворов редко происходит во время производственного процесса 28, но более вероятна во время манипуляции и добавления лекарства вручную 6, 9, 33, 34
Правила использования
- Перед использованием все инфузионные контейнеры с раствором должны быть тщательно осмотрены на предмет наличия в них трещин, дефектов, осадка или твердых примесей
- Не допускается повторная венепункция одним и тем же катетером
- Должны быть регламентированы правила смены инфузионных систем 25
- Количество манипуляций с инфузионными системами должно быть сведено к минимуму, так как каждая манипуляция ведет к увеличению риска микробной контаминации
- По возможности, должно использоваться максимальное количество стерильных барьеров
Устройства для обеспечения безопасности
Список литературы
1 Ghiglione JF, Martin-Laurent F, Pesce S. (2015) Microbial ecotoxicology: an emerging discipline facing contemporary environmental threats. Environ Sci Pollut Res; DOI 10.1007/s11356-015-5763-1
2 Gabriel J. (2008) Infusion therapy. Part two: Prevention and management of complications. Nurs Stand; 22(32): 41-8
3 World Health Organization 2002
4 Ducel G. Les nouveaux risques infectieux. Futuribles. 1995;203:5–32
5 Guembe M, Martín-Rabadán P, Echenagusia A, Camúñez F, Rodríguez-Rosales G, Simó G, Echenagusia M, Bouza E. (2012) How should long-term tunneled central venous catheters be managed in microbiology laboratories in order to provide an accurate diagnosis of colonization? J Clin Microbiol;50(3):1003-7
6 O‘Grady NP, Alexander M, Dellinger EP, Gerberding JL, Heard SO, Maki DG, Masur H, McCormick RD, Mermel LA, Pearson ML, Raad II, Randolph A, Weinstein RA. 2002
7 European Centre for Disease Prevention and Control. Prevalence of MRSA in Europe 2008
8 Hidron AI, Edwards JR, Patel J, Horan TC, Sievert DM, Pollock DA, Fridkin SK; National Healthcare Safety Network Team; Participating National Healthcare Safety Network Facilities. (2008) NHSN annual update: antimicrobial-resistant pathogens associated with healthcare-associated infections: annual summary of data reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2006-2007. Infect Control Hosp Epidemiol. 2008 Nov;29(11):996-1011
9 Centers for Disease Control and Prevention (CDC)
10 Hebert C, Weber SG. (2011) Common approaches to the control of multidrug-resistant organisms other than methicillin-resistant Staphylococcus aureus (MRSA). Infect Dis Clin North Am. 2011 Mar;25(1):181-200
11 Shah H, Bosch W, Thompson KM, Hellinger WC. (2013) Intravascular catheter-related bloodstream infection. Neurohospitalist; 3(3): 144-51
12 Mermel LA. (2011) What is the predominant source of intravascular catheter infections? Clin Infect Dis. 2011 Jan 15;52(2):211-2
13 Rosado V, Romanelli RM, Camargos PA. (2011) Risk factors and preventive measures for catheter-related bloodstream infections. J Pediatr (Rio J); 87(6): 469-77
14 Jamieson EM, McCall JM, Whyte LA. Practice 21: Intravenous therapy. In: Jamieson EM, McCall JM, Whyte LA. Clinical nursing practices. 5. Edition, Edinburgh [u.a.]: Elsevier Churchill Livingstone 2007; 169-176
15 WHO, 2002, Prevention of hospital-acquired infections. A practical guide. 2nd edition
16 Khan, Hassan Ahmed; Baig, Fatima Kanwal; Mehboob, Riffat (2017): Nosocomial infections. Epidemiology, prevention, control and surveillance. In Asian Pacific Journal of Tropical Biomedicine 7 (5), pp. 478–482. DOI: 10.1016/j.apjtb.2017.01.019
17 Uslusoy E., Mete S. (2008) Predisposing factors to phlebitis in patients with peripheral intravenous catheters: a descriptive study. J Am Acad Nurse Pract; 20(4): 172-80
18 Bouchoucha S, Benghachame F, Trifa M, Saied W, Douira W, Nessib MN, Ghachem MB. (2010) Deep venous thrombosis associated with acute hematogenous osteomyelitis in children. Orthop Traumatol Surg Res; 96(8): 890-3
19 Raad I. (1998) Intravascular-catheter-related infections.Lancet; 351(9106): 893-8.
20 Hanberger H, Walther S, Leone M, Barie PS, Rello J, Lipman J, Marshall JC, Anzueto A, Sakr Y, Pickkers P, Felleiter P, Engoren M, Vincent JL; EPIC II Group of Investigators. (2011) Increased mortality associated with methicillin-resistant Staphylococcus aureus (MRSA) infection in the intensive care unit: results from the EPIC II study. Int J Antimicrob Agents; 38(4): 331-5
21 Rosenthal VD, Maki DG. (2004) Prospective study of the impact of open and closed infusion systems on rates of central venous catheter-associated bacteremia. Am J Infect Control; 32(3): 135-41.
22 Gastmeier P, Geffers C, Brandt C, Zuschneid I, Sohr D, Schwab F, Behnke M, Daschner F, Rüden H. (2006) Effectiveness of a nationwide nosocomial infection surveillance system for reducing nosocomial infections. J Hosp Infect; 64(1): 16-22
23 Zingg W, Holmes A, Dettenkofer M, Goetting T, Secci F, Clack L, Allegranzi B, Magiorakos AP, Pittet D; systematic review and evidence-based guidance on organization of hospital infection control programmes (SIGHT) study group. (2015) Hospital organisation, management, and structure for prevention of health-care-associated infection: a systematic review and expert consensus. Lancet Infect Dis. 2015; 15(2): 212-24
24 Sax H, Clack L, Touveneau S, Jantarada Fda L, Pittet D, Zingg W; PROHIBIT study group. (2013) Implementation of infection control best practice in intensive care units throughout Europe: a mixed-method evaluation study. Implement Sci; 8: 24
25 World Health Organization. 2004
26 Royal College of Nursing (RCN). 2010
27 World Health Organization. 2009 World Health Organization. WHO Guidelines on Hand Hygiene in Health Care. WHO Library Cataloguing-in-Publication Data,
28 MMWR Morbitity and Mortality Weekly Report. 2002 Morbitity and Mortality Weekly Report. Guideline for Hand Hygiene in Health-Care Settings. Recommendations of the Healthcare Infection Control Practices Advisory Committee and the HICPAC/SHEA/APIC/IDSA Hand Hygiene Task Force. Recommendations and Reports, Oct 25, 2002, (51) No. RR-16
29 Grayson ML, Jarvie LJ, Martin R, Johnson PD, Jodoin ME, McMullan C, Gregory RH, Bellis K, Cunnington K, Wilson FL, Quin D, Kelly AM, 2008
33 Royal College of Nursing. 2005
34 Scales K. Vascular access: a guide to peripheral venous cannulation. Nurs Stand. 2005; 19(49): 48-52
35 NIOSH. Preventing Occupational Exposures to Antineoplastic and other Hazardous Drugs in Healthcare Settings. 2004
bloodstream infection. International Journal of Antimicrobial Agents 2008; 31: 161-165
52 Plowman RP, Graves N, Robers JA. Hospital Aquired Infection. Office of Health Economics, London 1997